欧盟批准抗血管生成的组合疗法治疗肺癌,有望率先在欧洲应用
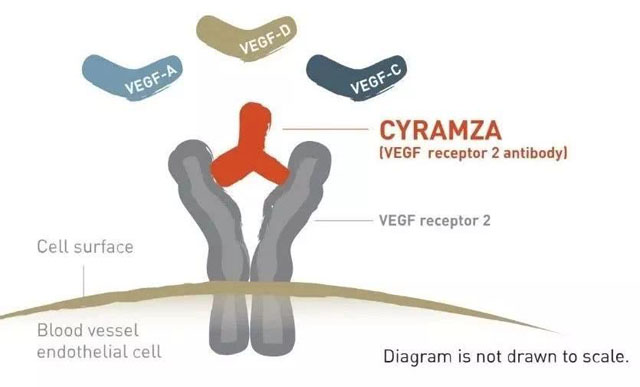
Cyramza的工作机理示意图(图片来源:Cyramza官网)
日前,礼来(Eli Lilly)宣布,欧洲药品管理局(EMA)人用医药产品委员会(CHMP)推荐欧盟批准其抗血管生成的单抗药物Cyramza(ramucirumab)与酪氨酸激酶抑制剂(TKIs)erlotinib构成的组合疗法,一线治疗携带EGFR基因突变的转移性非小细胞肺癌(NSCLC)成人患者。此前,礼来已经向美国和日本的药品监管机构递交了监管申请,预计双方将在2020年采取监管行动。
肺癌是导致癌症死亡的首要因素。据新闻稿发布的统计信息,在全球范围内,每年有180万人因肺癌死亡。NSCLC是一种最为常见的肺癌,约占肺癌患者比例的80%-85%。其中,约有10%-35%的NSCLC患者携带EGFR突变。
隶属于受体酪氨酸激酶家族的EGFR是一种跨膜的促进细胞生长和分裂的生长因子受体蛋白。在健康状态下,EGFR在细胞外的受体部分受生长因子等配体的紧密调控,需要与之相结合后引发受体二聚化,进而激活下游信号通路。但是EGFR细胞内部分的酪氨酸激酶蛋白域的突变,可能造成这些EGFR不需要与配体结合就可以被持续激活,进而导致细胞异常增殖,并将健康组织转化为癌症。携带EGFR基因突变的患者对TKIs疗法非常敏感,而TKIs和其它疗法构成的组合疗法则有潜力延缓疾病进展,以及延缓TKIs抗性的出现。
血管内皮生长因子(VEGF)受体2拮抗剂Cyramza,是一款抗血管生成疗法。Cyramza通过阻断VEGF受体2和VEGF-A,VEGF-C和VEGF-D的特异性结合来阻断该信号通路的激活。而阻断VEGF蛋白与血管的连接则有助于通过减缓血管生成和肿瘤的血液供应,从而抑制肿瘤生长。此前,Cyramza已经获得美国FDA的批准,作为二线疗法治疗胃癌,NSCLC,结直肠癌,和肝细胞癌(HCC)。
CHMP给出的意见是基于一项名为RELAY研究的积极结果,该研究是一项随机,双盲的3期临床试验,共有449名携带EGFR基因突变(外显子19缺失或外显子21 L858R替代突变)的转移性NSCLC患者参与。试验结果表明,与安慰剂和erlotinib组成的活性对照组相比(12.4个月),Cyramza与erlotinib构成的组合疗法使患者的无进展生存期(PFS)得到显著改善(19.4个月),达到试验的主要终点。此外,在缓解持续时间,第二次进展或死亡时间(PFS2),和需要靶向治疗的时间(time on targeted therapy)等次要或探索性终点方面,组合疗法组患者皆有所改善。
“基于RELAY研究的数据,CHMP做出了积极的推荐意见。这证明了同时靶向EGFR和VEGFR通路来治疗NSCLC患者的潜力,”礼来肿瘤学总裁Anne White女士说:“CHMP给出的积极意见是将这种疗法带给携带EGFR突变转移性肺癌患者的重要一步。”(来源:药明康德)
推荐
-

-

QQ空间
-

新浪微博
-

人人网
-

豆瓣






